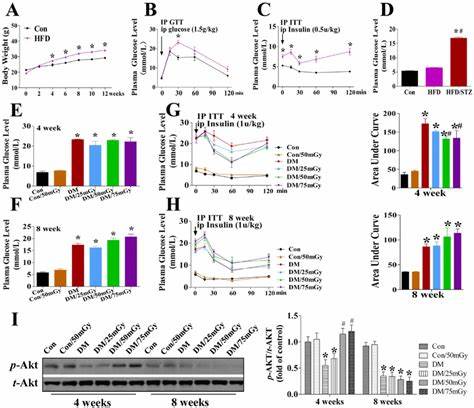
Die Erforschung der neuronalen Mechanismen hinter Typ-2-Diabetes (T2D) hat in den letzten Jahren erhebliche Fortschritte gemacht und rückt zunehmend die zentrale Rolle des Gehirns in den Fokus. Insbesondere Agouti-related peptide (AgRP)-Neuronen, die im hypothalamischen arcuate nucleus (ARC) lokalisiert sind, gewinnen dabei an Bedeutung. Ihre Hyperaktivität wurde in Mausmodellen mit Typ-2-Diabetes als ein entscheidender Faktor identifiziert, der zur anhaltenden Erhöhung des Blutzuckerspiegels, der sogenannten Hyperglykämie, beiträgt. Diese Erkenntnisse könnten das Verständnis von T2D vertiefen und neue therapeutische Ansätze aufzeigen. AgRP-Neuronen sind bekannt dafür, den Energiehaushalt über die Steuerung von Hunger und Stoffwechselprozessen zu regulieren.
Sie produzieren neurochemische Botenstoffe wie das Agouti-related Peptide, Neuropeptid Y (NPY) und Gamma-Aminobuttersäure (GABA), die zusammenwirken, um die Aktivität anderer Neuronen zu modulieren und somit Essverhalten und Energieverbrauch zu beeinflussen. Bei gesunden Tieren und Menschen tragen diese Neuronen dazu bei, ein Gleichgewicht zwischen Nahrungsaufnahme und Energieverbrauch zu erhalten. In der Pathophysiologie des Typ-2-Diabetes nimmt die Rolle der AgRP-Neuronen eine paradoxe, aber zentrale Stellung ein. In verschiedenen Studien an genetisch veränderten Mäusen, insbesondere den sogenannten Lepob/ob-Mäusen, die eine Leptin-Defizienz aufweisen und ein verbreitetes Modell für Adipositas und Typ-2-Diabetes darstellen, wurden die Aktivität dieser Neuronen als überhöht identifiziert. Dieses Übermaß an Aktivität führt zu einer Dysregulation der Glukosehomöostase, die durch anhaltend hohe Blutzuckerwerte gekennzeichnet ist.
Leptin ist ein Hormon, das normalerweise vom Fettgewebe ausgeschüttet wird und das Gehirn über den Energiestatus des Körpers informiert. Ein Mangel an Leptin oder eine Resistenz gegenüber diesem Hormon in den Zielneuronen begünstigt die Überaktivierung der AgRP-Neuronen. Diese Überaktivierung unterdrückt die melanocortin-4-Rezeptor (MC4R)-Signalgebung, die essenziell für die Regulation von Energieverbrauch und Glukosemetabolismus ist. Das Ergebnis ist eine ausgeprägte Hyperglykämie, wohingegen Auswirkungen auf den Appetit und das Körpergewicht nicht zwangsläufig in gleichem Maße beobachtet werden. Neuere experimentelle Ansätze haben gezeigt, dass eine gezielte Inaktivierung der AgRP-Neuronen bei Lepob/ob-Mäusen zu einer signifikanten und langanhaltenden Normalisierung des Blutzuckerspiegels führt.
Dabei beeinträchtigt die Inaktivierung dieser Neuronen weder die Nahrungsaufnahme noch den Energieverbrauch, Körpergewicht oder Körperfettanteile. Dies weist darauf hin, dass die AgRP-Neuronen speziell für die Hyperglykämie, nicht aber für Fettleibigkeit in diesem Krankheitsmodell verantwortlich sind. Zur gezielten Inaktivierung dieser Neuronen wurde eine genetische Technik eingesetzt, bei der ein Adeno-assoziierter Virus (AAV) mit einer cre-induzierbaren Tetanustoxin-GFP-Kassette in den ARC des Hypothalamus injiziert wurde. Dieser Ansatz führte zu einer dauerhaften Hemmung der AgRP-Neuronenfunktion. Die darauf folgende stabile Normalisierung des Blutzuckerwertes belegt direkt die kausale Rolle dieser Neuronen bei der Diabetesentwicklung.
Interessanterweise war diese Blutzuckerkontrolle nicht mit Veränderungen in der Insulinsekretion verbunden. Tatsächlich nahm der Insulinspiegel im Plasma nach der Inaktivierung der AgRP-Neuronen ab, was darauf hindeutet, dass die Hyperinsulinämie, wie sie typischerweise bei Lepob/ob-Mäusen beobachtet wird, zumindest teilweise durch die neuronale Aktivität dieser spezifischen Zellpopulation getrieben wird. Weitere Untersuchungen der Leber, einem zentralen Organ der Glukose- und Fettstoffwechselregulation, zeigten, dass die Leberfettwerte sich durch AgRP-Neuroneninaktivierung nicht signifikant veränderten. Allerdings wurde eine erhöhte Glykogenspeicherung festgestellt, was auf eine verbesserte Speicherung von Glukose in der Leber hindeutet. Zudem nahmen die Laktatspiegel im Plasma zu, was als Hinweis auf eine gesteigerte hepatische Glukoseaufnahme und Glukoseverwertung gewertet wird.
Ein weiterer bedeutsamer Aspekt betrifft die Reduktion von Corticosteron - dem wichtigsten Glukokortikoid bei Mäusen - nach AgRP-Neuroneninaktivierung. Ein erhöhter Corticosteronspiegel ist bei Lepob/ob-Mäusen ein häufig beobachtetes Phänomen und trägt zur Hyperglykämie und Insulinresistenz bei. Die spezifische Absenkung dieses Hormons durch die Hemmung der AgRP-Neuronen legt nahe, dass diese Neuronen auch die Aktivität der hypothalamisch-hypophysär-adrenalen (HPA)-Achse modulieren, die mit Stressreaktionen und dem Glukosestoffwechsel verbunden ist. Im Gegensatz dazu zeigte sich kein signifikanter Einfluss auf die Glukagonspiegel, ein weiteres wichtiges hormonelles Regulator der Blutglukose. Die Rolle des vom Gehirn gesteuerten Stoffwechsels und insbesondere der melanocortinen Schaltkreise gewinnt bei der Behandlung von Diabetes an Bedeutung.
So wurde bereits gezeigt, dass zentrale Injektionen von Fibroblasten-Wachstumsfaktor 1 (FGF1) eine langanhaltende Remission der Hyperglykämie in Lepob/ob-Mäusen hervorrufen. Die antidiabetische Wirkung von FGF1 scheint über die Hemmung der AgRP-Neuronen vermittelt zu werden, da FGF1 die Aktivität dieser Zellen unterdrückt und die Signalwege des MC4R aktiviert. Die direkte Inaktivierung der AgRP-Neuronen konnte somit die Wirkung von FGF1 nachahmen, was diesen zellulären Mechanismus unterstreicht. Diese Erkenntnisse werfen auch ein neues Licht auf die Komplexität der mit Leptin und melanocortinen System assoziierten Signalwege. So ist bekannt, dass AgRP-Neuronen einen antagonistischen Effekt auf MC4R haben, der im Gleichgewicht mit dem agonistischen Einfluss der POMC-Neuronen steht.
Dieses fein abgestimmte Zusammenspiel reguliert nicht nur Appetit und Körpergewicht, sondern auch den Glukosestoffwechsel. Ein Ungleichgewicht, wie es bei Leptinmangel und der resultierenden AgRP-Hyperaktivität zu beobachten ist, resultiert folglich in metabolischen Störungen wie Diabetes. Die Bedeutung dieser neuronalen Netzwerke geht über die Grundlagenforschung hinaus und birgt therapeutisches Potenzial. Medikamente, die AgRP-Neuronen hemmen oder das MC4R-Signal verstärken, könnten künftig eine zielführende Strategie zur Behandlung von insulinresistenter Hyperglykämie sein. Bereits existierende Antidiabetika, wie GLP-1-Rezeptor-Agonisten, scheinen teilweise über neuronale Hemmung der AgRP-Zellen ihre Wirksamkeit zu entfalten, was die Attraktivität dieses Ansatzes weiter untermauert.
Trotz der positiven Effekte der AgRP-Neuroneninaktivierung auf die Blutzuckerkontrolle besteht eine Differenzierung bei der Wirkung auf den Energiehaushalt. Während AgRP-Neuronen für die Hyperglykämie unabdingbar sind, scheint die Steuerung von Nahrungsaufnahme und Fettleibigkeit in Leptin-defizienten Mäusen von anderen neuronalen Populationen abhängig zu sein. Die Identifizierung dieser neuronalen Pfade bleibt eine wichtige Aufgabe für weitere Forschungen und könnte dazu beitragen, differenzierte Therapiestrategien für Diabetes und Adipositas zu entwickeln. Abschließend verdeutlichen die jüngsten Studien, dass das zentrale Nervensystem, insbesondere die Aktivität der AgRP-Neuronen, eine essentielle Rolle bei der Pathogenese von Typ-2-Diabetes einnimmt. Durch gezielte inaktivierende Eingriffe an diesen Neuronen konnte im Mausmodell eine nachhaltige Normalisierung der Blutzuckerwerte erzielt werden, ohne den Energiehaushalt zu beeinflussen.
Dieses Wissen schafft eine neue Perspektive für die Erforschung und Behandlung von Diabetes, die das Gehirn als therapeutischen Ansatzpunkt ins Zentrum rückt. Die zukünftige Erforschung der neuronalen Netzwerke und der Bedeutung ihrer Neurotransmitter wird vermutlich wegweisend sein für innovative Behandlungsformen, die jenseits der bisherigen medikamentösen Ansätze neue Möglichkeiten eröffnen, die Lebensqualität von Diabetespatienten erheblich zu verbessern.