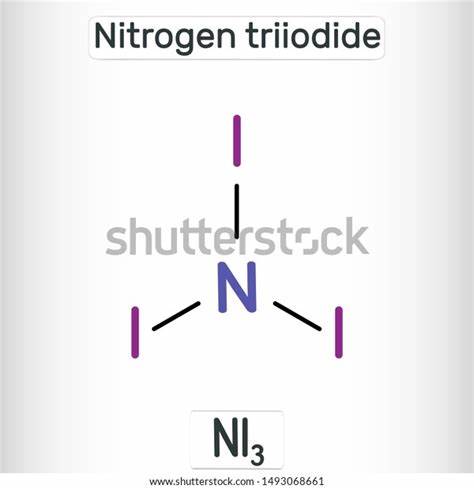
Stickstofftriiodid mit der chemischen Formel NI3 ist eine faszinierende, aber äußerst gefährliche Substanz der anorganischen Chemie. Trotz seiner geringen praktischen Nutzbarkeit ist es aufgrund seiner spektakulären Eigenschaften und seiner extremen Empfindlichkeit als Demonstrationsmittel in der Chemie bekannt. Die Verbindung ist ein dunkel gefärbter Feststoff, der sich durch seine herausragende Empfindlichkeit gegenüber mechanischen Reizen auszeichnet. Schon die leiseste Berührung kann zu einer heftigen Explosion führen, begleitet von einem charakteristischen violetten Ioddampf. Diese Fähigkeit, schon durch den leichtesten Kontakt zu detonieren, macht NI3 zu einem besonders spannenden, wenn auch riskanten Untersuchungsgegenstand in der Forschung und im Bildungsbereich.
Chemischer Aufbau und molekulare Struktur von Stickstofftriiodid Stickstofftriiodid besteht aus einem Stickstoffatom, das mit drei relativ großen Iodatomen verbunden ist. Die Seltenheit und Schwierigkeit bei der Untersuchung dieser Verbindung resultiert unter anderem aus der enormen Instabilität und der hohen Empfindlichkeit des Moleküls. NI3 besitzt eine pyramidenförmige Molekülgestalt, ähnlich jener von Ammoniak, mit einer C3v-Symmetrie. Diese Struktur wurde erstmals durch Raman-Spektroskopie näher untersucht. Die räumliche Anordnung der drei Iod-Atome um das kleine Stickstoffzentrum verursacht eine erhebliche sterische Überlastung.
Dieses Sterische Hindernis verringert die Aktivierungsenergie für die Zersetzung der Verbindung erheblich, was letztlich zu ihrer Explosivität führt. Synthese und typische Erscheinungsformen Die herkömmliche Methode zur Herstellung von Stickstofftriiodid beruht auf der Reaktion von elementarem Iod mit Ammoniak. Bei der Synthese unter tiefkühlenden und anhydrieren Bedingungen entsteht zunächst ein Komplex, NI3 verbunden mit mehreren Ammoniakmolekülen. Dieser Komplex geht bei Erwärmung in die einfachere einwertige Adduktform NI3·NH3 über. Dieser Feststoff bildet in der kristallinen Phase Kettenstrukturen aus, in denen sich die einzelnen NI3-Gruppen durch Iodbrücken verbinden.
Zwischen diesen Ketten befinden sich die Ammoniakmoleküle, die durch intermolekulare Wechselwirkungen stabilisierend wirken können. Diese stabile Komplexform ist besonders bei niedrigen Temperaturen in einer feuchten, ammoniakhaltigen Atmosphäre haltbar. Explosivitätsmechanismen und Sicherheitsaspekte Das Hauptmerkmal von Stickstofftriiodid ist seine extreme Empfindlichkeit gegenüber Berührung und mechanischer Beanspruchung. Die aufgestaute Spannung infolge der Ladung und Größe der drei Iodatome neben einem kleinen Stickstoff führt zu einer niedrigen Zersetzungsenergie. Die Kernreaktion bei der Zersetzung gibt eine große Menge an Energie und stabile Endprodukte wie elementaren Stickstoff und Iod frei.
Dieser Vorgang ist thermodynamisch sehr günstig, was sich durch die heftigen und lauten Explosionen bemerkbar macht, die das Material beim Kontakt mit einer Feder oder sogar der Bewegung in der Luft verursacht. Es ist bemerkenswert, dass NI3 auch durch Alphastrahlung oder Kernspaltungsprodukte zur Explosion angeregt werden kann, was es zum einzigen bekannten chemischen Explosivstoff macht, der durch diese Strahlungsarten zur Detonation gebracht wird. Diese Eigenschaft macht den Umgang mit diesem Material äußerst heikel und beschränkt jedwede praktische Anwendung. Aufgrund der hohen Gefahr ist selbst die Lagerung oder der Transport nicht möglich. Zersetzungsreaktionen und Nachweis Bei der Zersetzung von NI3 entstehen hauptsächlich Stickstoffgas und Iod, letzteres als violetter Dampf, der oft nach der Explosion in Form von orangenen bis violetten Flecken sichtbar ist.
Diese Iodreste lassen sich durch chemische Mittel wie Natriumthiosulfat leicht entfernen oder verdampfen bei entsprechender Luftzufuhr von selbst. Die Reaktionsgleichungen zeigen eine teilweise Komplexität, vor allem bei Verbindungen mit Ammoniak, wobei Nebenprodukte wie Ammoniumiodid entstehen. Diese Nachweise sind für die praktische Handhabung und das spätere Reinigen der experimentellen Materialien von großer Bedeutung. Bedeutung in der Chemieausbildung und Demonstrationen Gerade wegen seiner spektakulären, jedoch kontrolliert geführten Explosionen wird Stickstofftriiodid in der Chemieausbildung oft eingesetzt, um Schülern und Studierenden die Reaktivität und Sensitivität chemischer Verbindungen anschaulich zu demonstrieren. Die Zubereitung in kleinen Mengen unter Aufsicht ermöglicht eindrucksvolle Demonstrationen, die den Regenbogen an Farben sowie den Knall zur Verdeutlichung chemischer Prinzipien nutzen.
Chemisches „Magie“ und Grenzfälle der Stabilität Wegen der außergewöhnlichen Reaktion auf Berührungen und sogar Luftbewegungen, kann die Arbeit mit NI3 als eine Art „chemische Magie“ gesehen werden. Die Instabilität des Stoffes zeigt äußerst deutlich, welche Rolle molekulare Struktur und Größe der Atome in der Stabilität eines Moleküls spielen. Während ansonsten stabile Substanzen in kleinen Liefermengen eher ruhig reagieren, ist NI3 ein Paradebeispiel, wie Deformationen und sterische Hürden zur Detonation führen können. Forschungsansätze und ungewöhnliche Synthesen Es gibt experimentelle Methoden, die versuchen, NI3 ohne Ammoniak herzustellen, um die Struktur näher und reiner untersuchen zu können. Ein Beispiel ist die Reaktion von Bor-Nitrid mit Iod-Monofluorid bei tiefer Temperatur, wobei NI3 in geringer Ausbeute entsteht.
Trotz dieses Fortschritts bleibt das Material wegen seiner Empfindlichkeit nur schwer handhabbar, und das Verständnis der Substanz erweitert nach wie vor Grundlagenwissen der anorganischen Chemie und Explosivstoffe. Fazit und Ausblick Stickstofftriiodid steht exemplarisch für die vielseitigen, teils extremen Eigenschaften von Halogenverbindungen mit Stickstoff. Seine beeindruckende Instabilität und die damit verbundenen spektakulären Explosionen machen es zu einem einzigartigen Lehrstück. Allerdings sind die Gefahren so bedeutend, dass die Handhabung nur erfahrenen Chemikern unter streng kontrollierten Bedingungen vorbehalten ist. Für zukünftige Forschungen bleibt die Herausforderung bestehen, neue Verbindungen mit vergleichbaren, aber kontrollierbaren Eigenschaften zu entwickeln.
Das Verständnis von NI3 trägt wesentlich zum Wissen über molekulare Spannung und deren Einfluss auf chemische Stabilität und Reaktivität bei.