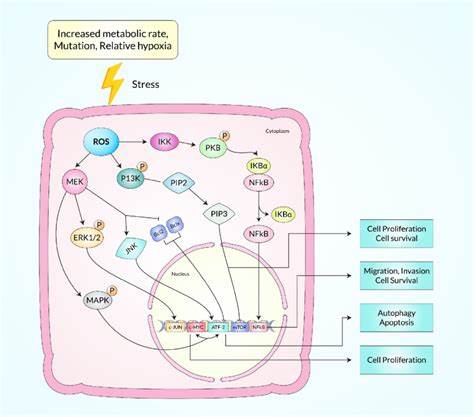
Die Entstehung von Krebs ist ein komplexer biologischer Prozess, der durch genetische Veränderungen und die Interaktion zahlreicher zellulärer Mechanismen bestimmt wird. Dabei spielt die Dauer des Zellzyklus eine zentrale Rolle, wie aktuelle wissenschaftliche Untersuchungen eindrucksvoll zeigen. Die Geschwindigkeit, mit der sich Zellen teilen, beeinflusst demnach maßgeblich, ob eine bestimmte Zelllinie zu Krebs neigt oder resistent gegenüber der onkogenen Transformation bleibt. Der Zellzyklus ist der Prozess, durch den eine Zelle wächst und sich teilt, um zwei Tochterzellen zu erzeugen. Er besteht aus verschiedenen Phasen, die genau reguliert sind, angefangen bei der Zellwachstumsphase (G1), über die DNA-Synthesephase (S), die Vorbereitung auf die Zellteilung (G2) bis hin zur Mitose (M).
Die Gesamtdauer dieses Zyklus variiert zwischen unterschiedlichen Zelltypen und kann durch äußere sowie innere Faktoren beeinflusst werden. Innovative Studien haben nun gezeigt, dass die Gesamtdauer des Zellzyklus (Tc) eine Vorhersagekraft für die Empfindlichkeit von Zellen gegenüber onkogenen Transformationen besitzt. In verschiedenen Gewebetypen konnten kürzere Zellzykluszeiten eindeutig mit einer höheren Krebsanfälligkeit in Verbindung gebracht werden. Im Umkehrschluss finden sich in krebskraftresistenten Zellpopulationen längere Zellzykluszeiten, was zu einer Art natürlicher Barriere gegen Tumorbildung führt. Diese Erkenntnisse wurden unter anderem in einem Mausmodell der Retinoblastomforschung gewonnen.
Dort wurde beobachtet, dass die Ursprungszellen des Tumors eine wesentlich kürzere Zellzyklusdauer aufwiesen als benachbarte, krebskraftresistente Zellen. Besonders auffällig war, dass Mutationen, die den Tumor unterdrückten, stets zu einer Verlängerung der Zellzyklusdauer führten, ohne jedoch in anderen typischen Krebsmerkmalen wie erhöhter Apoptoserate, Seneszenz oder Immunantwort Veränderungen hervorzurufen. Es wurde somit klar, dass nicht einfach nur die klassischen Kennzeichen von Krebs wie ungehemmtes Wachstum, Umgehung der Apoptose oder Erhöhung der Angiogenese entscheidend sind, sondern dass der Zellzyklus als »taktgebendes« Prinzip fungiert, das den Erfolg onkogener Transformationen maßgeblich beeinflusst. Dies erklärt, warum mutierte Zellen oft unbeschadet bleiben und sich nicht unmittelbar zu Krebszellen entwickeln – eine natürliche Fluchtmechanismus wird durch die Regulierungen des Zellzyklus gewährleistet. Parallel zu Untersuchungen im Auge konnten ähnliche Mechanismen in anderen Gewebearten identifiziert werden, darunter die Hypophyse und das Lungengewebe.
So zeigte sich beispielsweise bei Mäusen, dass insbesondere Zellen der Hypophyse mit kurzer Zellzyklusdauer deutlich häufiger Tumoren entwickelten als Zellen mit längeren Zellzykluszeiten. Im Lungengewebe, das besonders vielfältige Zelltypen enthält, wurden neuroendokrine Zellen als besonders tumoranfällig gegenüber Verlustfunktionen bestimmter Tumorsuppressorgene identifiziert. Auffällig war, dass diese Zellen ebenfalls die kürzeste Zellzyklusdauer unter den untersuchten Zelltypen hatten. Im Gegensatz dazu wiesen Alveolarzellen und Clubzellen längere Zellzykluszeiten auf und entwickelten seltener maligne Tumore. Die Rolle der Zellzyklusdauer zeigt sich auch bei onkogenen Mutationen, die unterschiedliche Zelltypen bevorzugt beeinflussen.
So aktivieren Mutationen im KRAS- oder BRAF-Gen Tumore überwiegend in Zellen mit kurzzyklischer Teilung, während andere Zelltypen trotz genetischer Veränderungen weniger anfällig bleiben. Diese Tatsache unterstützt die These, dass Tc ein universelles Merkmal ist, das Krebsentstehung bestimmt und Tumorprädisposition vorhersagen kann. Wichtig ist, dass Veränderungen der Zellzyklusdauer nicht zwangsläufig mit einer Änderung der Anzahl der teilenden Zellen einhergehen. In verschiedenen Experimenten wurde beobachtet, dass die Zahl der proliferierenden Zellen häufig unverändert blieb, obwohl die Zellzyklusdauer sich deutlich verlängerte. Das legt nahe, dass es vor allem auf die Geschwindigkeit der Zellteilung ankommt und nicht bloß auf den Anteil der Zellen, der sich gerade in der Teilung befindet.
Andere klassische Mechanismen der Tumorunterdrückung wie Apoptose, zelluläre Seneszenz oder Immunaktivierung wurden in den untersuchten Beispielen nicht durch Tumorsuppressor-gesteuerte Anpassungen signifikant beeinflusst. Diese Beobachtung verstärkt die Annahme, dass die Regulation des Zellzyklus nicht nur ein zusätzlicher Faktor ist, sondern einen Schlüsselmechanismus darstellt, mit dem entwickelnde Gewebe die Krebstumorentstehung kontrolliert verhindern können. Dieser paradigmatische Wandel bietet weitreichende Möglichkeiten für die Prävention und Therapie von Krebs. Therapeutische Ansätze, die den Zellzyklus gezielt verlängern, könnten das Risiko der Transformation von genetisch veränderten Zellen deutlich senken und somit eine neue Dimension der Krebsprävention eröffnen. Es gibt bereits vielversprechende Hinweise, dass eine moderate pharmakologische Hemmung bestimmter Cyclinabhängiger Kinasen (CDKs) diesen Effekt erzielen kann, ohne das normale Zellwachstum in gesundem Gewebe zu beeinträchtigen.
Vor allem für Hochrisikopatienten – beispielsweise Menschen mit genetischen Prädispositionen oder bestehenden onkogenen Mutationen – könnten solche Zyklus-stabilisierenden Interventionen eine effektive vorbeugende Maßnahme sein. Die Herausforderung wird darin bestehen, die Balance zwischen ausreichender Verlängerung des Zellzyklus und Erhalt der Gewebefunktionalität zu meistern. Zudem ermöglicht das Wissen um die Bedeutung der Zellzyklusdauer eine präzisere Identifikation von Zellen mit erhöhtem Transformationspotenzial. Dies hilft nicht nur, das Tumorgeschehen besser zu verstehen, sondern erlaubt auch gezielte diagnostische Strategien, um frühe neoplastische Veränderungen zuverlässiger zu erkennen. Zukunftsforschung kann hier anknüpfen und untersuchen, welche molekularen Mechanismen genau die Zellzyklusdauer in unterschiedlichen Zelltypen bestimmen und wie onkogene Mutationen diese Prozesse beeinflussen.
Auch die Rolle spezifischer CDKs wie CDK2 und CDK1, die in aktuellen Studien mit der Zellzyklusregulation eng verbunden sind, sollte weiter erforscht werden. Es ist davon auszugehen, dass die Integration von Signalen aus verschiedenen zellulären Wegen die Geschwindigkeit der Zellteilung kontrolliert und somit ein Türöffner oder Bremser für die Tumorentwicklung ist. Angesichts der Tatsache, dass das Festlegen der Zellzyklusdauer auch epigenetische und differenzierungsbezogene Faktoren beinhaltet, eröffnet sich ein multidisziplinärer Forschungsbereich, der die klassische Onkologie mit Entwicklungsbiologie und Zellzyklus-Forschung verbindet. Die Integration dieser Erkenntnisse könnte langfristig zur Entwicklung neuer Medikamente und Behandlungsprotokolle führen, die präzise auf die Dynamik der Zellteilung zugeschnitten sind. Abschließend lässt sich festhalten, dass die Zellzyklusdauer eine bislang unterschätzte, aber fundamentale Determinante im Krebsentstehungsprozess darstellt.
Dieses feine biologische Timing entscheidet darüber, ob eine Zelle trotz onkogener Belastung gesund bleibt oder zum Ursprung eines Tumors wird. Das Verständnis und die gezielte Modifikation dieser Zellzykluskontrolle könnten den Weg ebnen für effektive Präventionsstrategien und Therapien, die das Auftreten von Krebs in noch nie dagewesener Weise kontrollieren und einschränken. Damit steht die Zellzyklusdauer als Schlüssel zum besseren Verständnis von Krebs im Zentrum zukunftsweisender biomedizinischer Forschung.