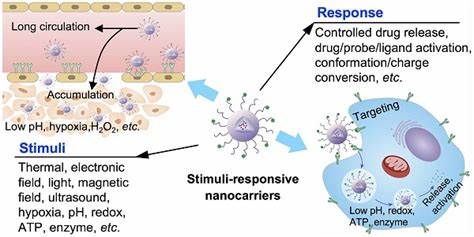
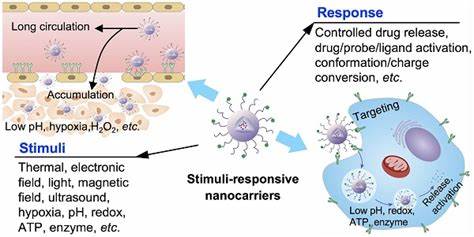
Biofilme gehören zu den hartnäckigsten Herausforderungen in der Behandlung bakterieller Infektionen. Diese komplexen Gemeinschaften von Mikroorganismen bleiben oft resistent gegenüber herkömmlichen antimikrobiellen Therapien, da sie sich in einer schützenden extrazellulären Matrix befinden. Die Folge sind chronische Infektionen, die oftmals eine langwierige oder sogar lebenslange Behandlung mit hohen Antibiotikadosierungen erfordern. Bei Patienten mit Diabetes, chronischen Wunden oder Zystischer Fibrose beispielsweise erschwert die Bildung von Biofilmen die wirksame Eliminierung der schädlichen Bakterien erheblich. Hier setzen neuartige Technologien an, die Ultraschall als Stimulus nutzen, um die Wirkung antimikrobieller Wirkstoffe gezielt zu verbessern und die Barrieren von Biofilmen zu überwinden.
Ein besonders vielversprechender Ansatz ist der Einsatz nanoskaliger Trägersysteme, sogenannter Nanodroplets, die mit antimikrobiellen Substanzen beladen sind und sich gezielt im Biofilm anreichern können. Diese Nanodroplets basieren oft auf modifizierten klinischen Kontrastmitteln und weisen eine Größe zwischen 125 und 250 Nanometern auf, was eine bessere Durchdringung des Biofilms ermöglicht als größere Mikrobubbles. Die Nanodroplets können verschiedene Klassen von antimikrobiellen Wirkstoffen beinhalten, wie Fluoroquinolone, antimikrobielle Peptide, makrolide Quorum-Sensing-Inhibitoren oder sogar metallorganische Komplexe, die verschiedene Angriffspunkte in den Bakterien adressieren. Die Anwendung von fokussiertem Ultraschall in geeigneter Frequenz und Intensität führt zur gezielten Aktivierung dieser Nanodroplets. Durch Ultraschall-gesteuerte Kavitation ereignet sich eine kontrollierte Phasenumwandlung der Nanodroplets in Mikrobubble-ähnliche Strukturen, die spontan oszillieren und biofilmbedingte Barrieren mechanisch zerstören können.
Dadurch wird nicht nur die schützende extrazelluläre Matrix aufgebrochen, sondern auch die Permeabilität der Bakterienzellen erhöht, was eine effizientere Aufnahme der antimikrobiellen Wirkstoffe in die biofilm-assoziierten Zellen bewirkt. Studien zeigen, dass die erforderlichen Konzentrationen von Antibiotika zur Erreichung der minimalen Biofilm-eradizierenden Konzentration (MBEC) bei Anwendung von Nanodroplets mit Ultraschall signifikant reduziert werden können – teilweise um das 20- bis 50-fache gegenüber den freiem Arzneimitteln. Besonders bemerkenswert ist, dass selbst hochresistente klinische Isolate, darunter MRSA und ESBL-produzierende E. coli, durch diese Methode wirksam bekämpft werden können. Die Kombination aus physikalischer Biofilmzerstörung und lokalisierter Wirkstofffreisetzung wirkt synergistisch und ermöglicht die Überwindung bisheriger Resistenzmechanismen.
Die Herstellungsprozesse dieser Nanodroplets sind gut etabliert und kombinieren lipidartige Phospholipide mit den Wirkstoffen, wobei unterschiedliche Wirkstofflokalisationen im Nanoträger möglich sind. Dies reicht von der Einbettung in die hydrophobe Lipidmembran bis hin zur elektrostatischen Bindung an die Nanodroplet-Oberfläche. Die Stabilität der Nanodroplets in Serum und bei Lagerung wurde nachgewiesen, was die klinische Relevanz und Anwendbarkeit untermauert. Neben der verbesserten Biofilmpenetration fördern die Nanodroplets eine erhöhte Antimikrobielle Aufnahme in die bakterielle Zelle. Die Wirkstoffverteilung verändert sich zugunsten der Membran- und Zytoplasmafraktionen.
Dies bedeutet, dass die antibiotische Wirkung direkt an den Stellen stattfinden kann, an denen sie am effektivsten ist. Besonders komplexe Wirkstoffe, wie metallorganische Ruthenium-Komplexe, zeigen eine deutlich erhöhte intrazelluläre Anreicherung und somit potenziell eine gestärkte antibakterielle Aktivität. Der Ultraschalleinsatz bietet darüber hinaus weitere therapeutische Vorteile. Durch kontrollierte, fokussierte Anwendung kann die Wirkstofffreisetzung räumlich und zeitlich genau gesteuert werden. Dies minimiert Nebenwirkungen, erhöht die Wirksamkeit vor Ort und reduziert den Gesamteinsatz von Antibiotika.
Studien in flow conditions, welche klinische Infektionsumgebungen simulieren, bestätigen die Anwendbarkeit des Systems in verschiedenen pathologischen Szenarien wie chronischen Wunden, Harnwegsinfektionen, Atemwegsinfektionen bei Zystischer Fibrose und Gelenkinfektionen. Besonders wichtig ist die Fähigkeit des Nanodroplet-Ultraschall-Systems, sogenannte „persister“ Zellen wirksam zu eliminieren. Diese physiologisch ruhenden bakteriellen Zellen sind ein Hauptgrund für die Rezidive von Infektionen und zeigen generell eine hohe Antibiotikaresistenz. Die Kombination aus Biofilmdisruption und gezielter Wirkstofffreisetzung trägt dazu bei, selbst diese schwer zu behandelnden Bakterienzellen nachhaltig zum Absterben zu bringen, was auf konventionelle Therapien häufig nicht zutrifft. Die klinische Translation dieser Technologie ist durch den Einsatz bereits zugelassener Komponenten, wie der Modifikation kommerzieller Ultraschallkontrastmittel und Nutzung kommerzieller Ultraschallgeräte, vielversprechend.
Dies erleichtert mögliche Zulassungsprozesse und erlaubt eine rasche Implementierung in der klinischen Praxis. Zudem bietet die Plattform Flexibilität, um neben klassischen Antibiotika auch neuartige antibiofilmaktive Substanzen oder enzymatische Biofilmmatrixabbauende Wirkstoffe zu transportieren. In der Ära zunehmender Multiresistenzen und limitierter neuer Antibiotikaentwicklungen erfüllen ultraschallaktivierte Nanodroplets eine wichtige Rolle. Sie eröffnen neue Therapieoptionen für chronische, hartnäckige Infektionen, bei denen traditionelle Antibiotika versagen. Die Verknüpfung physikalischer und pharmakologischer Strategien könnte dabei helfen, die Wirksamkeit verfügbarer Medikamente radikal zu steigern, Resistenzentwicklungen zumindest zu verlangsamen und die Behandlungskosten sowie Patientenbelastungen zu reduzieren.