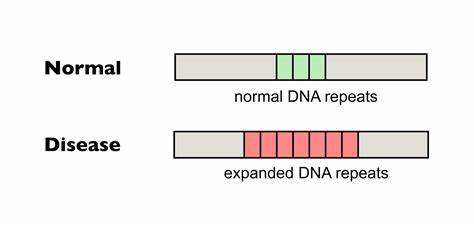
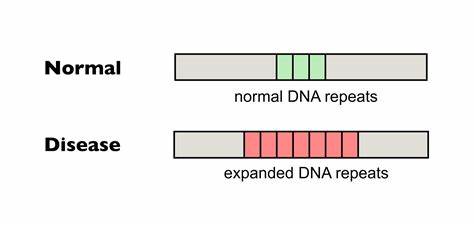
Die Huntington-Krankheit ist eine verheerende neurodegenerative Erkrankung, die durch die Expansion von CAG-Trinukleotidwiederholungen im Huntingtin-Gen ausgelöst wird. Je länger diese Wiederholungen sind, desto schwerwiegender ist in der Regel der Krankheitsverlauf. Ein entscheidender Faktor für den Schweregrad und den Verlauf der Erkrankung ist dabei nicht nur die ursprüngliche Länge der CAG-Repeat-Sequenz bei Geburt, sondern auch deren Instabilität und fortschreitende somatische Expansion im Laufe des Lebens. Diese somatischen Erweiterungen treten insbesondere in betroffenen Gehirnregionen auf und gelten als zentrale Einflussgröße für den Zeitpunkt des Krankheitseintritts und das Fortschreiten der Symptome. Entsprechend groß sind die Hoffnungen, durch Einflussnahme auf die Stabilität dieser Wiederholungen therapeutische Fortschritte erzielen zu können.
Die jüngste Forschung zur Basen-Editierung bei Trinukleotid-Repeat-Erkrankungen zeugt von einem wichtigen Durchbruch in dieser Hinsicht. Im Kern der neuen Forschungsansätze steht das Konzept der sogenannten Basen-Editoren, spezialisierte molekulare Werkzeuge, mit denen gezielt einzelne Basenpaare der DNA verändert werden können, ohne dabei Doppelstrangbrüche im Erbgut hervorzurufen. Diese Technologie unterscheidet sich wesentlich von klassischen Genome-Editing-Techniken, die auf der Erzeugung von Doppelstrangbrüchen basieren und oft mit unerwünschten Nebeneffekten verbunden sind. Bei der Huntington-Krankheit zielen Wissenschaftler auf die präzise Veränderung der CAG-Repeat-Sequenz ab, indem sie einzelne Cytosin- oder Adeninbasen in der DNA zu anderen Basen umwandeln, um die Wiederholungssequenz zu unterbrechen und damit stabiler und weniger anfällig für Expansionen zu machen. Neueste Studien haben gezeigt, dass durch die Einführung von sogenannten „Interruptions“ in die CAG-Wiederholungen – also das Einfügen oder Ersetzen einzelner CAG-Sequenzen durch leicht abgewandelte Triplets, wie zum Beispiel CAA – die Neigung der Repeat-Region zur Expansion erheblich reduziert werden kann.
In natürlichen Populationen sind solche Interruptions bereits bekannt und korrelieren mit einem milderen Krankheitsverlauf oder einem späteren Auftreten der Symptome. Genetische Analysen von Huntington-Patienten verdeutlichen dabei, dass eine einzelne CAA-Unterbrechung im CAG-Repeat die Krankheitsmanifestation im Durchschnitt um mehr als ein Jahrzehnt verzögern kann. Die Anwendung von Cytosin-Baseneditoren (CBEs) erlaubt es, gezielt diese Unterbrechungen in den CAG-Tract einzubauen, ohne dabei die kodierende Aminosäuresequenz des Proteins zu verändern – ein entscheidender Vorteil, da so keine unerwünschten Veränderungen der Huntingtin-Proteinstruktur entstehen. Die präklinischen Ergebnisse, sowohl in Patienten-Zelllinien als auch in Mäusemodellen, zeigen beeindruckende Effekte. In Fibroblasten von Huntington-Patienten gelang es mit Baseneditoren, die CAG-Repeats mit bis zu 80 Prozent Effizienz zu unterbrechen.
Die Folge war eine signifikante Verringerung der somatischen Expansionen während längerer Zellkultivierungszeiten. Insbesondere in einem Mausmodell, das die menschliche Huntington-Genmutation mit über 100 CAG-Wiederholungen trägt, führte die Behandlung mit AAV9-Vektoren, die die Baseneditoren und spezifische Guide-RNAs ins zentrale Nervensystem einschleusten, zu einer robusten Interruption der HTT-Repeats. Die damit verursachten Veränderungen im Genom ließen sich in Hirngeweben wie dem Kortex und dem Striatum nachweisen, den Hauptbetroffenen Hirnregionen bei Huntington. Außerdem reduzierte die Behandlung signifikant das Ausmaß der somatischen Expansionen verglichen mit unbehandelten Kontrolltieren. Neben dem Verhindern weiterer Expansionen wurde sogar eine Verkürzung der vorhandenen Repeatlänge beobachtet, was auf eine Rückbildung pathologischer Repeat-Verlängerungen hindeutet.
Wichtig für die Therapieforschung ist dabei auch die Sicherheit der Methode. Genome-weite Analysen der möglichen Off-Target-Effekte zeigten, dass die meisten unerwünschten Editierungen in nicht-kodierenden Bereichen des Genoms auftreten und dass ein Großteil dieser Nebenwirkungen für die Zellfunktion ohne wesentliche Konsequenzen bleibt. Nur eine kleine Anzahl von Proteinkodierenden Genen wurde von basenspezifischen Veränderungen betroffen, wobei viele der Veränderungen entweder still waren (synonym) oder natürliche Varianten im Menschen nachahmten. Diese Ergebnisse sind zwar vielversprechend, zeigen jedoch auch, dass eine ausführliche weitere Untersuchung der Sicherheit bei zehnfacher Tiefe unabdingbar ist, um unerwünschte Effekte durch off-target editing auszuschließen. Auch für die verwandte Erkrankung Friedreich-Ataxie wurden ähnliche Strategien erfolgreich erprobt.
Hierbei liegt die Pathologie in der Expansion von GAA-Trinukleotiden im FXN-Gen, was die Expression des Frataxin-Proteins hemmt. Durch Anwendung von Adenin-Baseneditoren (ABEs) gelang es, Interruptions in die GAA-Repeatregion einzufügen, was die Repeat-Stabilität verbesserte und sogar die Frataxin-Expression in Patienten-Zellen wieder anhob. Mittels AAV9-vermittelter Lieferung von ABEs in pharmazeutischen Mausmodellen zeigte sich ebenfalls eine signifikante Reduktion der somatischen GAA-Expansionen. Diese Fortschritte erhöhen die Hoffnung, repetitive neurologische Erkrankungen zukünftig gezielt über den DNA-Schaden-Mechanismus zu therapieren, statt nur Symptome zu lindern. Das Konzept der somatischen Repeat-Interruption stellt einen Paradigmenwechsel dar: Anstatt die pathologische Mutation komplett aus dem Genom zu entfernen, wird sie in einen stabileren, weniger toxischen Zustand überführt.
Die praktische Umsetzung in vivo, etwa über neonatalen direkten Hirninfusionen mit AAV9-Trägern, ebnete den Weg für eine kontinuierliche und präzise Korrektur in relevanten Hirnregionen, was für eine spätere translationale Anwendung entscheidend ist. Natürlich stehen Herausforderungen bevor, wenn es um die klinische Umsetzbarkeit geht. Die Verteilung der Vektoren in unterschiedlichen Geweben, die Reduktion off-target Effekte, die immunologische Verträglichkeit und die Langzeit-Sicherheit sind zentrale Fragen, deren Beantwortung die Qualitätssicherung für künftige Therapien darstellt. Auch der Zeitpunkt der Intervention und die Effektivität bei bereits bestehenden Krankheitsstadien müssen noch erforscht werden, da die Expansion im Gehirn eine Jahrzehnte dauernde kumulative Belastung darstellt. Nichtsdestotrotz ist die Hinwendung zur Basen-Editierung als potenziellem therapeutischem Werkzeug ein bedeutsamer Fortschritt.




![Domain/OS Design Principles (1989) [pdf]](/images/1E5E6EAD-D0D8-4814-A356-4FED55AA17AE)