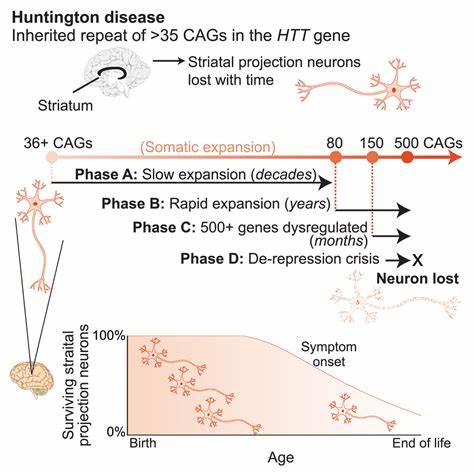
Die Huntington-Krankheit (HD) stellt eine schwere neurodegenerative Erkrankung dar, die durch eine abnormale Expansion von CAG-Trinukleotid-Wiederholungen im HTT-Gen verursacht wird. Diese pathogenen Wiederholungen führen zu Fehlfunktionen des Huntingtin-Proteins und letztlich zu einem fortschreitenden Verlust neuronaler Funktionen, vorrangig im Striatum und Kortex. Die Erkrankung ist bisher unheilbar, und heutige Behandlungsmöglichkeiten können lediglich die Symptome lindern, nicht jedoch das Fortschreiten der Krankheit stoppen oder rückgängig machen. Das Verständnis der molekularen Mechanismen, die zur Expansion dieser trinukleotidischen Wiederholungen beitragen, hat sich in den letzten Jahren deutlich vertieft. Dabei wurde erkannt, dass die Länge der CAG-Repeats nicht nur bei der Geburt, sondern auch während des Lebens, insbesondere in somatischen Zellen des Gehirns, weiter zunehmen kann.
Diese sogenannte somatische Instabilität begünstigt eine zunehmende toxic Amyloidbildung und verschärft die neuronale Degeneration. Ein entscheidender Faktor in der Pathogenese von HD ist somit die Vermeidung oder Verlangsamung dieser somatischen Repeat-Expansionen. In jüngerer Zeit rückt die Methode des Basen-Editings (Base Editing) in den Fokus der Forschung als potenziell bahnbrechende therapeutische Strategie. Anders als klassische Genom-Editing-Methoden mit CRISPR-Cas9, bei denen Doppelstrangbrüche im DNA-Strang erzeugt werden, ermöglicht Basen-Editing eine präzise und zielgerichtete Veränderung einzelner DNA-Basen ohne derartige Brüche. Zwei Haupttypen dieser Editoren sind Cytosin-Base-Editoren (CBE), die C•G-Basenpaare in T•A-Basenpaare umwandeln, und Adenin-Base-Editoren (ABE), die A•T-Basenpaare in G•C umwandeln können.
Die gezielte Modifikation innerhalb der repetitiven CAG-Sequenzen ermöglicht es, spezifische Unterbrechungen im erweitertem Repeattrakt zu erzeugen, welche natürlicherweise in manchen, weniger pathogenen Allelen vorkommen und mit einer erhöhten genomischen Stabilität assoziiert sind. Die Forschungsarbeit von Matuszek et al. brachte nun erstmals einen bedeutenden Fortschritt bei der Anwendung von Basen-Editoren, um die genomische Stabilität von HTT-CAG-Expansionen sowohl in menschlichen Patientenzellen als auch in Mausmodellen zu verbessern. Dabei wurde die Methode genutzt, um in den CAG-Repeats gezielt CAA-Unterbrechungen einzufügen, welche die Polyglutamin-Sequenz des Huntingtin-Proteins zwar nicht verändern, jedoch die Neigung zu somatischer Expansion signifikant verringern. Experimentell gelang es zunächst, in humanen Fibroblasten von Huntington-Patienten mit langen CAG-Tracts durch mRNA-basierte Elektroporation eines optimierten Cytosin-Base-Editors und entsprechender guide-RNAs eine hohe Effizienz an Repeat-Unterbrechungen zu erzielen.
Bemerkenswerterweise blieben in den behandelten Zellen die bisher beobachteten somatischen Expansionen aus und es kam sogar zu einer leichten Verkürzung der Repeatlänge im Verlauf mehrerer Zellteilungen. Dies deutet darauf hin, dass die Erzeugung von Unterbrechungen purer CAG-Sequenzen ein effektiver Weg sein kann, den instabilen Repeattrakt in eine stabilere Form zu überführen. Um die Wirksamkeit und Sicherheit in vivo zu prüfen, wurden die Bausteine des Basen-Editors in Adeno-assoziierte Viren vom Serotyp 9 (AAV9) verpackt und neonatalen Htt.Q111-Mäusen mittels intraventrikulärer Injektion verabreicht. Die Wahl dieses Serotyps basierte auf seiner bewährten Neuronotropie, insbesondere in hirnspezifischen Regionen, die für die Huntington-Krankheit relevant sind.
Nach der Behandlung zeigte sich eine signifikante Einführung von CAA-Unterbrechungen in den CAG-Repeats im Kortex und Striatum. Zeitlich betrachtet nahm die Editierhäufigkeit zu, da der AAV-Vektor persistent exprimierte. Wichtig ist, dass dieser Eingriff nicht nur die somatische Expansion reduzierte, sondern auch eine Verkürzung der Repeatlänge bewirkte – ein Faktor, der potenziell das Fortschreiten der Erkrankung verlangsamen könnte. Umfassende Analysen der genomweiten Off-Target-Effekte der eingesetzten Base-Editoren mittels CIRCLE-seq und Hochdurchsatzsequenzierung bestätigten, dass die über 90 % der unerwünschten Veränderungen in nicht-kodierenden oder intronischen Bereichen auftraten und meist keine proteinkodierenden Sequenzen betrafen. Die wenigen proteinverändernden Mutationen waren zumeist konservativ oder wurden biologisch als benigne eingestuft.
Dies unterstreicht die relative Sicherheit und Spezifität des Verfahrens, wenngleich für den klinischen Einsatz weitere Sicherheitsstudien erforderlich sind. Parallel zu Huntington konnte die Methode auch auf Friedreich-Ataxie (FRDA) übertragen werden, eine weitere häufige trinukleotidische Expansionskrankheit, die intronische GAA-Repeats im FXN-Gen betrifft. Durch adenines Basen-Editing und gezielte Einführung von A•T>G•C-Unterbrechungen in GAA-Repeat-Trakten konnten bei Patientenzellen signifikant Alzheimer-ähnliche molekulare Marker rückgebildet und die FXN-Genexpression erhöht werden. In vivo konnten entsprechende AAV9-ABEdCH-Vektoren in FRDA-Mausemodellen zu ähnlichen Ergebnis führen: Neben einer hohen Editiereffizienz wurde eine signifikante Verringerung der somatischen Repeat-Expansion und eine teilweise Wiederherstellung des Genexpressionsprofils erzielt. Die Forschungsarbeiten liefern somit den Beweis, dass das gezielte Basen-Editing von pathogenen Trinukleotid-Expansionen eine neuartige und vielversprechende Therapieoption darstellt.
Durch die Einfügung stabilisierender Unterbrechungen wird die DNA-Instabilität gezielt vermindert, was sowohl Somatische Expansion hemmt als auch möglicherweise die Krankheitsprogression verlangsamen kann. Trotz dieser bedeutenden Fortschritte präzisiert die Studie auch die Herausforderungen, die vor einer klinischen Anwendung bewältigt werden müssen. So sind die Auswirkungen langfristiger Base-Editor-Expression, insbesondere in verschiedenen Zelltypen und Geweben, noch nicht vollständig erfasst. Die Entwicklung von Delivery-Systemen mit zeitlich begrenzter oder gezielter Expression sowie die Modifikation von Enzymen mit noch geringerer Off-Target-Aktivität sind wichtige zukünftige Schritte. Zudem sind weiterführende Untersuchungen an Tiermodellen mit ausgeprägteren Krankheitsphänotypen nötig, um den Effekt der Repeat-Interruptions auf das tatsächliche Krankheitsgeschehen zu evaluieren.