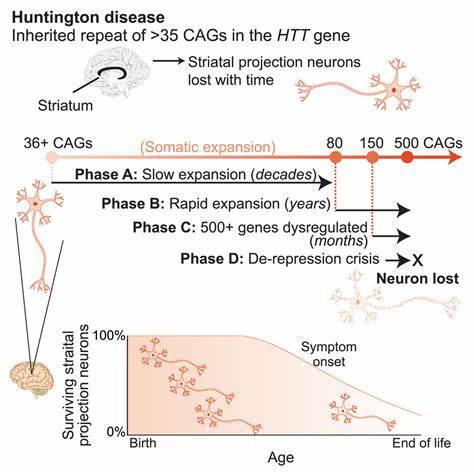
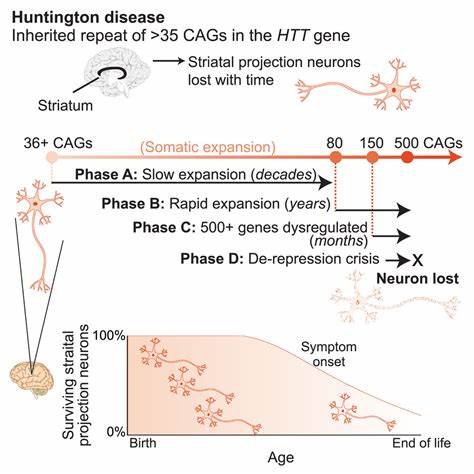
Die Huntington-Krankheit zählt zu den neurodegenerativen Erkrankungen, die durch die Expansion bestimmter repetitiver DNA-Sequenzen, sogenannter trinukleotidischer Wiederholungen, ausgelöst werden. Konkret handelt es sich bei den pathogenen Sequenzen um CAG-Wiederholungen im HTT-Gen, deren Ausdehnung das Risiko und den Schweregrad der Erkrankung maßgeblich beeinflusst. Trotz intensiver Forschung existieren bislang keine Therapien, welche die zugrunde liegenden genetischen Ursachen direkt adressieren oder die somatischen Repeat-Expansionen wirksam reduzieren könnten. Aktuelle wissenschaftliche Fortschritte eröffnen nun jedoch vielversprechende Perspektiven: Mit Hilfe innovativer Basen-Editing-Technologien lassen sich die gefährlichen Wiederholungssequenzen in menschlichen Zellen und Tiermodellen gezielt verändern und dadurch stabilisieren. Dies könnte die neurologischen Schäden signifikant mindern und das Fortschreiten der Huntington-Krankheit verlangsamen.
Die molekulare Basis der Huntington-Krankheit liegt in einer schädlichen Sequenzamplifikation der CAG-Trinukleotide, die kodierend für die Aminosäure Glutamin sind. Wenn die Anzahl der Wiederholungen über ein bestimmtes Schwellenwert hinauswächst, wird das Htt-Protein fehlgefaltet und besitzt toxische Eigenschaften, die insbesondere die Nervenzellen im Striatum und Kortex des Gehirns beeinträchtigen. Erschwerend kommt hinzu, dass diese CAG-Repeat-Regionen auch im Verlauf des Lebens einer Person weiter expandieren können – sogenannte somatische Repeat-Expansionen. Diese Instabilität verstärkt die Pathologie und kann den Ausbruch und die Verschlechterung der Erkrankung beschleunigen. Hier setzt die innovative therapeutische Strategie der gezielten Veränderung dieser Repeat-Sequenzen mittels Basen-Editoren an.
Basen-Editing stellt eine revolutionäre Gentechnologie dar, die es ermöglicht, einzelne Basenpaare in der DNA ohne den Einsatz von DNA-Doppelstrangbrüchen präzise umzuwandeln. Von großem Interesse sind dabei Cytosin- und Adenin-Basen-Editoren, welche spezifisch C-G in T-A beziehungsweise A-T in G-C verwandeln können. Im Kontext der Huntington-Krankheit bedeutet dies, dass anstatt die reinen CAG-Wiederholungen zu verkürzen, durch eine gezielte Basen-Umwandlung in der Sequenz Unterbrechungen eingefügt werden können, welche die mechanistischen Ursachen der somatischen Expansion mildern. Studien zeigen, dass solche Interruptionssequenzen, die natürlicherweise bei einigen Personen vorkommen, die genomische Stabilität erhöhen und den Krankheitsverlauf verzögern. In vitro Experimente mit patienteneigenen fibroblastären Zellen verdeutlichen, dass man durch Cytosin-Basen-Editoren gezielt CAG-Sequenzen in HTT-Genen in CAA-Unterbrechungen umwandeln kann.
Diese Synonyme Veränderungen führen dazu, dass die Polypeptidkette unverändert bleibt, aber die Wiederholungsstruktur in der DNA stabiler wird. Die Folge ist eine signifikante Verminderung von CAG-Repeat-Expansionen über Zellkulturpassagen hinweg, was einen direkten Einfluss auf die potenzielle Krankheitsprogression vermuten lässt. Neben Zellkulturen konnten diese Effekte auch in einem etablierten Mäusemodell der Huntington-Krankheit, dem Htt.Q111-Modell, bestätigt werden. Durch die AAV9-vermittelte Verabreichung des Basen-Editors per intravenöser Injektion bei neugeborenen Mäusen wurde eine gezielte Synonym-Interruption des CAG-Wiederholungsabschnitts im zentralen Nervensystem erzielt.
Das Ergebnis war eine signifikante Reduktion der somatischen Repeat-Expansion im Cortex und Striatum – den Schlüsselregionen, die von der Huntington-Krankheit betroffen sind. Bemerkenswert ist, dass die Behandlungsgruppe trotz des fortgesetzten Wachstums der Mäuse im Vergleich zu Kontrolltieren eine deutlich geringere mittlere Länge der CAG-Repeats zeigte. Neben der Huntington-Krankheit wurden ähnliche Basen-Editing-Technologien auf die Friedreich-Ataxie angewandt, eine weitere durch Repeat-Expansionen verursachte neurodegenerative Erkrankung. Dort liegt die pathogene Expansion im FXN-Gen in Form verlängerter GAA-Trinukleotide vor. Auch hier konnten Adenin-Basen-Editoren eingesetzt werden, um gezielt GAA-Sequenzen in stabile Sequenzunterbrechungen umzuwandeln.
In Patientenfibroblasten zeigte diese Intervention eine erhöhte FXN-Genexpression sowie eine Verminderung von somatischen Repeat-Expansionen, was auch im YG8s-Mausmodell der Friedreich-Ataxie bestätigt wurde. Diese Parallelen untermauern das Potenzial generalisierbarer therapeutischer Ansätze für unterschiedliche TNR-Erkrankungen. Die umfassenden genomweiten Off-Target-Analysen sind essentiell, um die Sicherheit solcher Gen-Editing-Technologien zu bewerten. Die Untersuchungen zeigten, dass die Basen-Editoren präzise an den Zielsequenzen wirken und dass potentiell unerwünschte Editierungen in anderen Genregionen überwiegend entweder nicht kodierend sind oder zu synonymen Codeänderungen führen. Seltene missense Mutationen wurden identifiziert, deren funktionelle Bedeutung jedoch als minimal eingestuft wird.
Aufgrund der großen Anzahl an genomischen Repeat-Sequenzen, die ähnliche Trinukleotid-Motive enthalten, ist das Verständnis und die Minimierung dieser Off-Target-Effekte eine zentrale Herausforderung bei der weiteren Entwicklung klinischer Anwendungen. Die verwendete AAV9-Virus-basierte Genlieferung zeigte eine hohe Effizienz bei der Transduktion von Neuronen in relevanten Hirnarealen. Neonatale Injektionen führten zu einer stabilen Expression der Basen-Editoren über mehrere Monate. Diese langanhaltende Expression erlaubte eine kontinuierliche Akkumulation der Interruptionssequenzen, welche zur Stabilisierung der Repeats beitrug. Allerdings gilt es noch zu klären, ob und wie sich die langfristige Expression auf potentielle Nebenwirkungen und Off-Target-Events auswirkt.
Alternative Liefermethoden und die Entwicklung von Editor-Varianten mit erhöhter Spezifität könnten diesen Aspekten entgegenwirken. Von klinischer Relevanz ist, dass die Modelle, sowohl die Patientenfibroblasten als auch die Tiermodelle, bislang nur die molekularen und genetischen Aspekte der Repeat-Expansionen abbilden. Die tatsächliche Auswirkung der Interruptions-induzierten Stabilisierung auf neurologische Funktionen und Symptomentwicklung in vivo bleibt noch zu erforschen. Allerdings legen zahlreiche genetische Studien nahe, dass das Vorhandensein von Unterbrechungen in CAG-Repeats den Krankheitsbeginn deutlich verzögern kann, was Hoffnung auf eine disease-modifying Therapie gibt. Zukünftige Forschung wird sich daher darauf konzentrieren, die Basen-Editing-Technologien für eine sichere und effiziente Anwendung im Menschen weiterzuentwickeln.