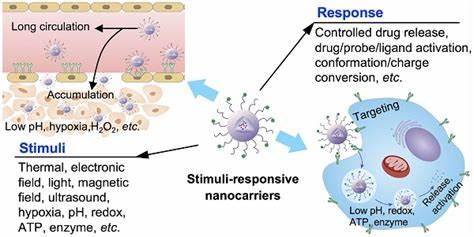
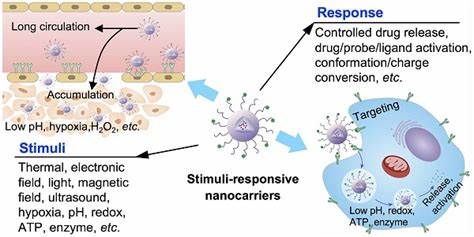
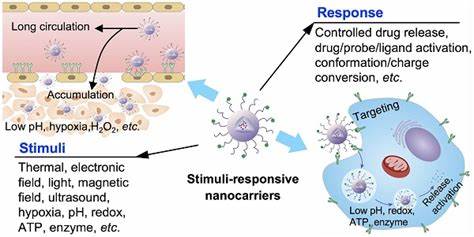
Chronische bakterielle Infektionen stellen in der heutigen Medizin eine erhebliche Herausforderung dar, vor allem aufgrund der Resistenzmechanismen und Schutzstrukturen wie Biofilmen, die Bakterien vor herkömmlichen Antibiotika schützen. Biofilme sind komplexe, von Bakterien selbst aufgebaute Gemeinschaften, eingebettet in eine schützende Matrix aus extrazellulären Makromolekülen. Diese Matrix erschwert das Eindringen antimikrobieller Substanzen und begünstigt die Bildung ruhender, metabolisch inaktiver Zellpopulationen, die sogenannten Persisterzellen. Aufgrund dieser Schutzmechanismen sind Biofilme oft resistent gegen konventionelle Therapien, was zu wiederkehrenden und oftmals chronischen Infektionsverläufen führt. Neue Behandlungsmethoden sind daher gefragt, um diese Limitationen zu überwinden und die Eradikation von Biofilmen zu ermöglichen.
Eine der vielversprechendsten Innovationen in der antibakteriellen Therapie ist die Kombination von Ultraschall mit nanoskaligen Trägersystemen, die auf gezielte Art und Weise antimikrobielle Wirkstoffe direkt in die Biofilmbereiche transportieren. Ultraschall, insbesondere fokussierter Ultraschall, bietet die Möglichkeit, Biofilme mechanisch zu stören – durch lokale Kavitationseffekte werden die Biofilmstrukturen geschwächt und die Barrierefunktion der Matrix reduziert. Gleichzeitig erlauben Ultraschall-aktivierte Nanodroplets die kontrollierte Freisetzung von Wirkstoffen genau am Infektionsort, was die Wirkstoffkonzentration vor Ort erhöht und systemische Nebenwirkungen minimiert. Diese Nanodroplets basieren häufig auf modifizierten phospholipidumhüllten Trägern, die mit antimikrobiellen Substanzen wie Antibiotika, Peptiden oder metallischen Komplexen beladen werden können. Durch die nanoskalige Größe – typischerweise im Bereich von 100 bis 250 Nanometern – sind diese Träger prädestiniert, die engen Strukturen und dichten Zellschichten der Biofilme besser zu durchdringen als herkömmliche Medikamente.
Die Lipidbeschichtung sorgt für Stabilität der Nanodroplets im physiologischen Milieu und fördert eine längere Verweildauer im Zielgebiet. Ein essenzieller Vorteil dieses Systems ist die Ultraschall-induzierte Phasenumwandlung von Nanodroplets in gasgefüllte Mikrobubbles. Diese Mikroblasen wirken als mechanische Werkzeuge, die bei aktiver Ultraschallbestrahlung oszillieren, biofilmzerstörende Kräfte freisetzen und gleichzeitig die Freisetzung der eingebetteten Wirkstoffe auslösen. Diese Doppelwirkung beseitigt sowohl die schützende Matrix als auch die darin eingebetteten Bakterien, was die Effektivität der Behandlung signifikant erhöht. Studien mit klinischen Isolaten hat gezeigt, dass Nanodroplets, beladen mit verschiedenen Wirkstoffen wie Azithromycin, Besifloxacin, Polymyxin B und einem rutheniumbasierten Komplex, in Kombination mit fokussiertem Ultraschall eine drastische Verringerung der benötigten Antibiotikadosis ermöglichen.
Konkret konnte die notwendige Wirkstoffkonzentration für die minimale bakterizide Wirkung (MBC), für die Biofilm-Eliminierung (MBEC) sowie für die Abtötung persistenter Zellen um ein Vielfaches gesenkt werden. Das bedeutet, dass wesentlich weniger Wirkstoff zum Einsatz kommt, was potenziell Nebenwirkungen und Resistenzentwicklung reduziert. Ein zentrales Qualitätsmerkmal dieser Methode ist die verstärkte Aufnahme der Wirkstoffe in die bakterielle Zelle selbst. Die Nanodroplets fördern eine verbesserte Penetration der Medikamente nicht nur durch die Biofilmmatrix, sondern auch in die subzellulären Kompartimente der Erreger. Insbesondere konnte eine deutlich erhöhte Konzentration der antimikrobiellen Substanzen in der bakteriellen Membran und im Zytoplasma nachgewiesen werden, was ihre Wirksamkeit zusätzlich steigert.
Während freies, nicht verkapseltes Antibiotikum oft nur begrenzt in die tieferen Schichten der Biofilme und letztlich in die Bakterien eintritt, ermöglichen die Nanodroplets dank Ultraschall-getriggerter Freisetzung und Biofilmdispergierung den Wirkstofftransport bis in die Zielzellen. Darüber hinaus hat das System auch gegen besonders problematische Phänotypen wie sogenannte Persisterzellen überzeugt. Diese Zellen sind metabolisch inaktiv und daher gegen typische Antibiotika fast immun, da die meisten Wirkstoffe auf aktive Stoffwechselwege angewiesen sind. Die Ultraschall-Behandlung fördert in Kombination mit Nanodroplets die Durchlässigkeit der Zellmembranen und die Reaktivierung ruhender Zellen, was diese empfindlicher gegenüber antimikrobiellen Mitteln macht. Somit kann die Kombination aus Ultraschall und Nanodroplets zur vollständigen Entfernung auch dieser schwer zu behandelnden Zellpopulationen führen.
Eine besondere Stärke des Ultraschall-gesteuerten Systems liegt auch in seiner Vielseitigkeit. Da bereits klinisch zugelassene Ultraschallgeräte und bekannte Wirkstoffe genutzt werden können, gestaltet sich die klinische Anwendung relativ unkompliziert und schnell umsetzbar. Die nanopartikuläre Formulierung ist kompatibel mit einer Vielzahl antimikrobieller Substanzen unterschiedlicher Wirkmechanismen, was die Anpassung an spezifische Erreger oder Infektionsarten erleichtert. Nicht zuletzt ist die Anwendung nicht auf Laborbedingungen beschränkt. Untersuchungen unter praxisnahen Bedingungen, die verschiedene Infektionsumgebungen wie cystische Fibrose, chronische Wunden, Harnwegsinfektionen und Gelenkinfektionen simulieren, zeigen die Wirksamkeit dieses Ansatzes gegen diverse klinisch relevante Biofilmbildner wie Staphylococcus aureus, Escherichia coli und Pseudomonas aeruginosa.
Gerade in solch variablen und komplexen Umgebungen, in denen Biofilme besonders hartnäckig sind, erweist sich der Ultraschall-aktive Nanodroplet-Ansatz als besonders adaptiv und robust. Trotz dieser vielversprechenden Ergebnisse ist die weitere Erforschung der zugrundeliegenden Mechanismen notwendig, insbesondere hinsichtlich der genauen Transport- und Freisetzungsprozesse auf subzellulärer Ebene. Auch Langzeitstudien zur Sicherheit, Immunverträglichkeit und zur Verhinderung von Resistenzen sind essentiell, um den klinischen Nutzen zu evaluieren. Alles in allem stellt die Kombination von antimikrobiellen Nanodroplets mit Ultraschall-Aktivierung einen bedeutenden Fortschritt in der Behandlung von Biofilm-assoziierten Infektionen dar. Diese multifunktionale Plattform überwindet entscheidende Hindernisse der herkömmlichen Antibiotikatherapie, indem sie für eine verbesserte Wirkstoffpenetration, gezielte Freisetzung und mechanische Biofilmzerstörung sorgt.
Gerade angesichts der steigenden Verbreitung multiresistenter Bakterienspezies und der limitierenden Wirksamkeit bestehender Medikamente bietet dieses innovative System eine hoffnungsvolle Perspektive für die klinische Praxis und das Management chronischer, schwer behandelbarer Infektionen. Die Zukunft der antibakteriellen Therapie liegt somit nicht allein in der Entwicklung neuer Wirkstoffe, sondern auch in der intelligenten Kombination vorhandener Medikamente mit modernen, physikalisch basierten Technologien wie dem Ultraschall-gesteuerten Nanodroplet-System. Die Integration von pharmakologischer Präzision mit physikalischer Biofilmkontrolle könnte künftig das Behandlungsspektrum erweitern, Therapiezeiträume verkürzen und die Belastung für Patienten erheblich reduzieren.