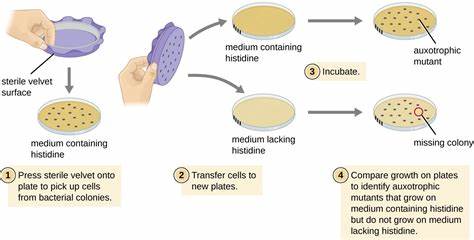
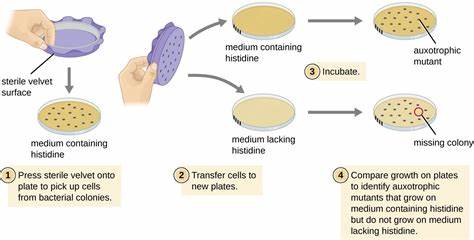
Die Erkenntnis über genetische Variationen des menschlichen Genoms hat in den letzten Jahrzehnten enorme Fortschritte gemacht. Die Sequenzierung ganzer Genome inzwischen routinemäßig möglich zu machen, hat eine Fülle von Daten zu genetischen Unterschieden zwischen Individuen geschaffen. Trotz der immensen Menge an genetischen Informationen stellt die funktionelle Bewertung der Bedeutung dieser Variationen eine große Herausforderung dar. Insbesondere die Identifikation von Mutationen, die Krankheiten verursachen, ist für die Entwicklung von Diagnose- und Therapieverfahren von zentraler Bedeutung. Seit Kurzem gewinnt eine innovative Methode an Bedeutung, die lebende Bakterien als Wirtszellen nutzt, um die Aktivität menschlicher Enzyme mit Krankheitsrelevanz zu analysieren.
Diese neuartige „Live Bacteria Enzyme Assay“-Technologie (LEICA) ermöglicht ein schnellere, kostengünstige und präzisere Bestimmung funktionaler Konsequenzen genetischer Varianten im Vergleich zu traditionellen in-vitro- oder Zellkultursystemen. Der Grundgedanke basiert darauf, dass bestimmte Enzyme aus menschlichen Stoffwechselwegen durch ihre bakteriellen Gegenstücke im Modellorganismus Escherichia coli ersetzt werden. Trotz der großen evolutionären Entfernung teilen Mensch und Bakterium viele gemeinsame Stoffwechselwege – besonders im Bereich der Glykolyse und anderer zentraler Energiestoffwechselprozesse. Durch den Austausch der bakteriellen Enzymgene mit humanen orthologen Genen samt jeweiliger Mutationen lassen sich die Auswirkungen von Sequenzvarianten direkt in lebenden Zellen untersuchen. Ein zentrales Merkmal dieses Ansatzes ist die Kopplung der Enzymaktivität an das Wachstum von E.
coli. Da der Stoffwechselfluss maßgeblich über spezifische Enzyme reguliert wird, reflektiert die Geschwindigkeit, mit der die Bakterien unter definierten Nährstoffbedingungen wachsen, die Aktivität der humanen Enzyme. Mutationen, die die enzymatische Funktion beeinträchtigen, führen daher zu einer veränderten Wachstumskinetik, die quantitativ messbar ist. So können Enzymvarianten innerhalb kurzer Zeit in hochdurchsatzfähigen Versuchsaufbauten charakterisiert und deren Krankheitsrelevanz abgeschätzt werden. Beispiele aus der Forschung illustrieren dies eindrucksvoll.
Die Untersuchung von Mutationen in den Genen für Glucose-6-Phosphat-Isomerase (GPI) und Glucose-6-Phosphat-Dehydrogenase (G6PD) – zwei Enzymen mit bekannter Bedeutung in häufigen erblichen Enzymopathien – zeigte eine starke Korrelation zwischen dem bakteriellen Wachstum und der biochemisch gemessenen Enzymaktivität. Insbesondere ist G6PD-Mangel eine der weltweit am häufigsten vererbten Enzymstörungen, die sich klinisch unter anderem durch hämolytische Anämien äußert. Die Vielfalt der bekannten Mutationen stellt dabei eine Herausforderung dar, welche durch den LEICA-Ansatz elegant überwunden wird. Die Vorteile des lebenden Bakteriensystems liegen neben der Geschwindigkeit in mehreren technischen und biologischen Faktoren. Traditionelle in-vitro-Methoden erfordern aufwendige Proteinisolationen und komplexe Assays, die oft für jede Enzymfamilie spezifisch adaptiert werden müssen.
Zudem bilden solche in vitro Bedingungen das zelluläre Milieu nur unzureichend ab, was die Aussagekraft für physiologische Funktionen einschränkt. Im Gegensatz dazu nutzt LEICA die physiologischen Bedingungen lebender Bakterienzellen mit ihren natürlichen Substraten, Cofaktoren und intrazellulären Kompartimenten. Dieser ganzheitliche Ansatz ermöglicht eine bessere Abbildung des funktionellen Status der Enzyme. Darüber hinaus bietet das System die Möglichkeit, gezielt Mutationen mittels Gentechnik in das humane Gen zu integrieren und so definierte Varianten zu testen. Das ermöglicht die Einschätzung nicht nur bekannter Varianten mit etablierter Pathogenität, sondern auch die schnelle Bewertung zuvor uncharakterisierter Polymorphismen.
Dadurch kann LEICA helfen, den Funktionsstatus genetischer Veränderungen aus Populationstudien oder der personalisierten Genomdiagnostik zu bewerten und die klinische Interpretation zu verbessern. Neben der Erfassung von Krankheitsassoziationen eignet sich das System hervorragend für das Screening potenzieller Wirkstoffe. Die Interaktion von kleinen Molekülen mit den humanen Enzymen innerhalb der bakteriellen Zelle lässt sich durch Wachstums- oder Inhibitionsmuster unmittelbar detektieren. Dies ermöglicht die Identifikation sowohl von Enzyminhibitoren als auch Aktivatoren und unterstützt somit die Medikamentenentwicklung und Wirkstoffoptimierung gegen enzymbezogene Erkrankungen. Ergänzend konnten mit LEICA beispielsweise bereits neue Aktivatoren für defekte G6PD-Mutanten beschrieben werden, die die Enzymaktivität steigern und somit einen therapeutischen Nutzen nahelegen.
Die mikrobiellen Wirtszellen bieten zudem den Vorteil einfacher Genetik, schneller Kultivierung und hoher Reproduzierbarkeit, was besonders für hohe Screening-Durchsatzzahlen relevant ist. Die Anwendung des Systems beschränkt sich nicht nur auf Enzyme des Glykolysestoffwechsels. So konnte beispielhaft die Aktivität des humanen Argininosuccinat-Lyase (ASL), eines Enzyms des Harnstoffzyklus mit Bedeutung bei der argininosuccinatischen Säureurie, durch einen entsprechenden E. coli-mutanten als lebendes Biosensor-System analysiert werden. Diese Vielseitigkeit belegt das Potential zur Erweiterung der Methode für zahlreiche enzymatische Defekte und Stoffwechselkrankheiten.
Wie jede Methode bringt der LEICA-Ansatz auch Einschränkungen mit sich. Die bakterielle Zellwand und Membran können die Permeabilität für bestimmte Wirkstoffe beeinflussen, was die Interpretation von In-vitro- oder In-vivo-Wirkungen komplexer Arzneistoffe erfordert. Zudem sind bakterielle Zellen keine perfekten Modelle für alle menschlichen zellulären Vorgänge, sodass Ergebnisse in Humanzellen validiert werden müssen. Darüber hinaus kann die bakterielle Expression menschlicher Proteine bei manchen Enzymen durch Faltung, Posttranslationale Modifikationen oder Oligomerisierung limitiert sein. Nichtsdestotrotz repräsentiert LEICA einen signifikanten Fortschritt gegenüber bestehenden Methoden und eröffnet neue Dimensionen in der schnellen funktionellen Charakterisierung genetischer Variationen.
Besonders im Kontext der personalisierten Medizin kann das System helfen, individuelle Mutationen funktionell einzuordnen und maßgeschneiderte Therapien besser zu entwickeln. Es ist zu erwarten, dass zukünftige Arbeiten die Plattform weiter verfeinern und komplexere menschliche Enzyme oder Multiproteinkomplexe integrieren. Außerdem könnte durch die Kombination mit maschinellem Lernen und bioinformatischen Tools die Prognosefähigkeit von Sequenzvarianten weiter verbessert werden. Die Integration von LEICA in diagnostische Routinen und Wirkstoffentwicklung verspricht signifikante Auswirkungen auf die Präzisionsmedizin und die Behandlung genetischer Stoffwechselerkrankungen. Zusammenfassend steht fest, dass der Einsatz von lebenden Bakterien als funktionelle Assaysysteme zur Enzymaktivitätsmessung eine neuartige und vielversprechende Methode ist, die die Lücke zwischen Genomsequenzierung und funktioneller Charakterisierung schließt.
Durch die Kopplung des bakteriellen Wachstums an die Funktion humaner Enzyme können Krankheitsmutationen nicht nur effizient erkannt, sondern auch potenzielle therapeutische Substanzen schnell evaluiert werden. Diese innovative Plattform bietet einen wertvollen Werkzeugkasten für die moderne biomedizinische Forschung, die Diagnostik und die Medikamentenentwicklung mit langfristigem Potenzial für zahlreiche Anwendungsbereiche.