Die Rolle genetischer Faktoren beim Auftreten und Verlauf neurodegenerativer Erkrankungen wie Demenz ist von großer Bedeutung und immer stärker Gegenstand wissenschaftlicher Studien. Insbesondere die genetischen Varianten, die den Eisenstoffwechsel im Körper beeinflussen, rücken zunehmend in den Fokus der Forschung. Hämochromatose, eine genetisch bedingte Eisenspeicherkrankheit, die durch Mutationen im HFE-Gen ausgelöst wird, stellt eine solche Beeinträchtigung des Eisenhaushalts dar. Neueste prospektive Untersuchungen bei älteren Erwachsenen liefern wichtige Erkenntnisse darüber, wie spezifische HFE-Genvarianten das Demenzrisiko beeinflussen könnten und offenbaren zudem interessante geschlechtsspezifische Unterschiede, die weitreichende Implikationen für die Prävention und Behandlung neurodegenerativer Erkrankungen haben könnten. Hämochromatose ist vor allem durch seine häufig in Europa verbreiteten Genmutationen bekannt, insbesondere die Varianten p.
Cys282Tyr und p.His63Asp. Diese Varianten führen zu einer Dysregulation des Eisenstoffwechsels, was erhöhten Eisenansammlungen im Organismus zur Folge hat. Eisen ist ein essentielles Spurenelement, das eine Schlüsselrolle bei zahlreichen zellulären Prozessen spielt, jedoch bei Überladung toxisch wirkt und oxidativen Stress verursachen kann. Im Gehirn führt eine Eisenüberladung möglicherweise zu Schäden an Nervenzellen und unterstützt so pathologische Prozesse, die mit Demenz einhergehen.
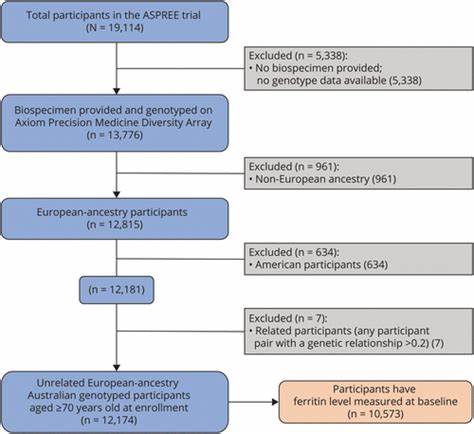
Die in einer groß angelegten prospektiven Studie untersuchte Kohorte bestand aus über 12.000 gesunden Menschen europäischer Abstammung ab einem Alter von 70 Jahren, die zu Beginn keinerlei Anzeichen von Demenz oder kognitiven Einbußen aufwiesen. Die Teilnehmer wurden hinsichtlich ihrer HFE-Genvarianten p.Cys282Tyr und p.His63Asp genetisch analysiert, und ihre Serumferritinwerte – ein Maß für Eisenreserven im Blut – wurden erfasst.
Die Forscher verfolgten über einen medianen Zeitraum von 6,4 Jahren das Auftreten von Demenzerkrankungen und werteten diese Daten mittels statistischer Modelle aus. Die Ergebnisse zeigten zunächst, dass sowohl Männer mit den p.Cys282Tyr+-Genvarianten als auch Frauen mit p.His63Asp+-Varianten tendenziell höhere Serumferritinwerte aufwiesen, was die erwartete Auswirkung der HFE-Mutationen auf Eisenwerte bestätigte. Andererseits bestand keine direkte Korrelation zwischen erhöhtem Ferritinspiegel und einem erhöhten Risiko für Demenz, was nahelegt, dass die Eisenüberladung im Blut allein nicht direkt als Risikofaktor für Demenz zu betrachten ist.
Besonders bemerkenswert war eine geschlechtsspezifische Differenz: Männer, die homozygot für die p.His63Asp-Variante waren, zeigte eine deutlich höhere Wahrscheinlichkeit, im Verlauf der Untersuchungszeit eine Demenzdiagnose zu erhalten. Diese Assoziation blieb auch nach Adjustierung für potenzielle Einflussfaktoren bestehen und belegte eine fast zweieinhalbfach erhöhte Demenzrisiko. Bei Frauen stellte sich dieser Zusammenhang hingegen nicht dar. Diese Erkenntnis weist darauf hin, dass männliche Träger der p.
His63Asp-HFE-Variante möglicherweise eine besondere genetische Vulnerabilität gegenüber Demenz aufweisen. Die Bedeutung dieser Ergebnisse ist breit gefächert. Zum einen unterstreicht die Studie, dass genetische Einflüsse auf neurodegenerative Erkrankungen komplex und nicht ausschließlich durch den direkten Einfluss von Eisenüberladung auf das Gehirn erklärbar sind. Vielmehr könnten andere Mechanismen involviert sein, die durch die HFE-Varianten vermittelt werden. Beispielsweise könnte die p.
His63Asp-Mutation neuronal-spezifische Stressreaktionen verstärken oder Entzündungsprozesse modulieren, die für die Demenzpathogenese relevant sind. Auch der Einfluss auf vaskuläre Gesundheit, Blut-Hirn-Schranke und zelluläre Eisenverteilung im Gehirn sollte genauer untersucht werden. Die geschlechtsspezifischen Unterschiede werfen weitere Fragen auf. Es ist bekannt, dass Frauen und Männer in vielen biologischen Belangen, darunter Hormonstatus, Immunreaktion und Stoffwechsel, unterschiedlich reguliert sind. Östrogene beispielsweise haben nachweislich eine schützende Wirkung auf den Eisenstoffwechsel und neuronale Gesundheit, dies könnte erklären, warum Frauen mit derselben Genvariante nicht denselben erhöhten Demenzrisiken ausgesetzt sind.
Zudem variieren auch Eisenreserven und deren Mobilisierung im Alter je nach Geschlecht, was die Interpretation von Genexpressions- und Krankheitsrisiken zusätzlich erschwert. Über die klinische Relevanz hinaus bietet diese Studie Grundlagen für weitergehende Forschungsarbeiten. Die Identifikation genetischer Risikofaktoren, die in Kombination mit anderen Biomarkern eingesetzt werden können, ist entscheidend für die Entwicklung personalisierter Präventionsstrategien. Gerade in einem demografischen Umfeld mit einer alternden Bevölkerung gewinnt die Früherkennung von Demenzrisiken zunehmend an Bedeutung. Das Wissen um spezifische genetische Profile kann zukünftig dazu beitragen, gezielte Interventionen einzuleiten, sei es durch Lebensstilmodifikationen, medikamentöse Ansätze oder eine engmaschige medizinische Überwachung.
Zudem könnten die Erkenntnisse Ansatzpunkte für die Erforschung neuer therapeutischer Ziele bieten. Wenn spezifische HFE-Genvarianten pathogenetisch mit Demenz verbunden sind, wäre die therapeutische Modulation des Eisenstoffwechsels im Gehirn eine interessante Strategie. Ebenso sind entzündliche und oxidative Stressmechanismen, die durch Eisen beeinflusst werden, potenzielle Angriffspunkte für neue Medikamente oder kombinierte Therapien, die auf die Verlangsamung des neurodegenerativen Prozesses abzielen. Eine Herausforderung bleibt jedoch die Überführung der epidemiologischen und genetischen Daten in die praktische Anwendung. Das Screening großer Bevölkerungsgruppen auf HFE-Varianten ist bisher nicht Teil der regulären Demenzvorsorge.
Die ethischen, finanziellen und praktischen Aspekte eines solchen Screenings müssen daher sorgfältig abgewogen werden. Außerdem sind weitere Studien erforderlich, um die Kausalität zwischen diesen Genvarianten und Demenz zu bestätigen und mögliche Wechselwirkungen mit anderen genetischen und Umweltfaktoren zu untersuchen. Abschließend unterstreichen die Ergebnisse der prospektiven Studie, dass genetische Variationen im HFE-Gen, speziell die p.His63Asp-Homozygotie bei Männern, ein bedeutsamer Risikofaktor für die Entwicklung von Demenz sein können. Diese Erkenntnis trägt zu einem besseren Verständnis der komplexen Zusammenhänge zwischen Genetik, Eisenstoffwechsel und neurodegenerativen Erkrankungen bei.
Gleichzeitig zeigt die Studie das Potenzial geschlechtsspezifischer Ansätze in Forschung und Therapie auf und stellt eine wertvolle Basis für zukünftige Untersuchungen zur Prävention und Behandlung von Demenz dar. Die interdisziplinäre Zusammenarbeit zwischen Genetikern, Neurologen und Epidemiologen wird hierbei eine entscheidende Rolle spielen, um effektive und maßgeschneiderte Strategien zur Bekämpfung von Demenz im Alter zu entwickeln.